Jest procesem beztlenowym, wieloetapowym, w czasie którego wielkocząsteczkowe związki organiczne rozkładane są przez bakterie i enzymy na związki proste, chemicznie stabilne (gównie metan i dwutlenek węgla). Cały proces przebiega w czterech etapach:
- hydroliza (uwodnienie) wielkocząsteczkowych związków organicznych; w tej fazie bakterie hydrolityczne za pomocą enzymów powodują rozkład celulozy, lignin, białek i tłuszczów, do związków rozpuszczalnych w wodzie, takich jak: kwasy tłuszczowe, amoniak, alkohole.
- acidogeneza – kolejna grupa bakterii, tzw. kwasowych, powoduje dalszy rozkład kwasów tłuszczowych do prostszych kwasów organicznych, alkoholi i aldehydów. Obie powyższe fazy są ściśle ze sobą powiązane i często nazywane fermentacją kwaśną
- octanogeneza – w fazie tej następuje przemiana kwasów organicznych, alkoholi i aldehydów w kwas octowy, wydziela się przy tym wolny wodór i dwutlenek węgla, które stają się substratami do produkcji metanu
- metanogeneza – bakterie metanowe wykorzystują kwas octowy, H2 i CO2 do produkcji metanu, faza ta nazywana jest więc fermentacją metanową.
Proces fermentacji metanowej jest ściśle uzależniony od tempa namnażania się bakterii metanogennych, które są wolniejsze w działaniu od bakterii kwasowych. Proces metanizacji osadów wymaga precyzyjnego dawkowania świeżego osadu, jak też nadzoru temperatury, odczynu środowiska i zawartości substancji toksycznych (o tym za chwilę), aby nie dopuścić do zbytniego namnażania się baterii kwaśnych. Wydłużenie fazy drugiej (kwaśnej) sprzyja obniżeniu pH w komorze fermentacyjnej i zwiększeniu stężenia CO2 w gazie pofermentacyjnym.
Fermentacja metanowa może przebiegać w układzie jednostopniowym (bez lub z odzyskiem gazu) i w układzie wielostopniowym, z odzyskiem gazu. Ze względu na temperaturę procesu fermentację dzielimy na:
- psychrofilową (temp. < 20°C)
- mezofilową (temp. 30-38°C)
- termofilową (>38°C, zwykle od 45-58°C)
W praktyce fermentację metanową prowadzi się najczęściej w temperaturze 35°C. Metan pozyskiwany jest dwiema drogami:
- poprzez biologiczny rozkład kwasu octowego przez bakterie heterotroficzne według reakcji
CH3COOH → CH4 + CO2
- przez redukcję dwutlenku węgla za pomocą bakterii autotroficznych
CO2 + 8H → CH4 + 2H2O
Cały proces fermentacji w formie blokowej przedstawiam poniżej.
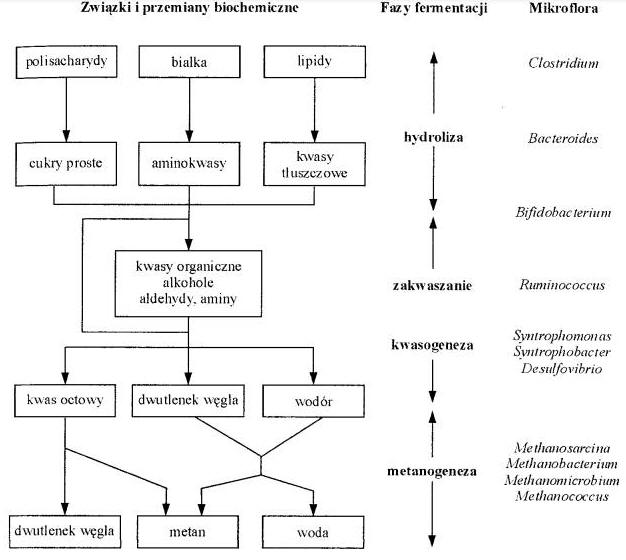
Rys. Schemat fermentacji metanowej (źr. Nasierowska. praca dyplomowa z fermentacji metanowej)
Czynniki wpływające na efektywność procesu fermentacji metanowej
Na wydajność procesu fermentacji metanowej mają wpływ czynniki fizyczne (temperatura procesu, intensywność mieszania, częstotliwość dawkowania świeżego osadu, dostępność światła), jak i chemiczne (skład chemiczny osadów, ich odczyn pH, zwartość substancji toksycznych, czy potencjał oksydacyjno-redukcyjny). Jedne z nich mają działanie przyspieszające, inne inhibitujące.
Temperatura
Jest jednym z najważniejszych czynników przyspieszających proces fermentacji. Temperatura wpływa zasadniczo na tempo wzrostu mikroorganizmów i ich biologię, a tym samym późniejszy skład biogazu. Jak już wyżej wspomniałem, w zależności od temperatury wyróżnia się trzy typy fermentacji: psychrofilową, mezofilową i termofilową. Na świecie zdecydowanie dominują procesy mezofilowe, zachodzące w temperaturze 35-38C. Wybór ten jest podyktowany dużą stabilnością procesu i stosunkowo niskimi nakładami energetycznymi, związanymi z koniecznością dostarczenia ciepła do komory fermentacyjnej. Nie odrzuca się jednocześnie procesów termofilowych, które pozwalają na znaczne skrócenie czasu fermentacji, uzyskanie większej ilości biogazu, a ponadto lepszą jego higienizację. W temperaturach mezofilowych trudno jest bowiem pozbyć się patogenów, które uniemożliwiają późniejsze rolnicze wykorzystanie osadów.
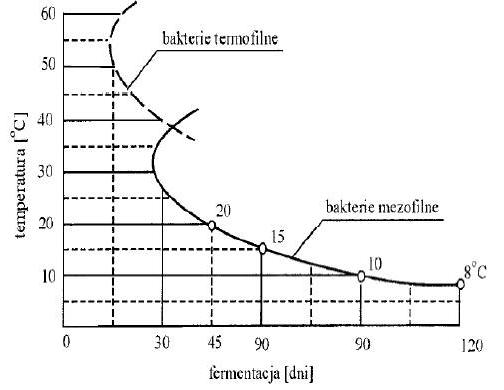
Rys. Wpływ temperatury fermentacji na czas jej trwania (źr. Imhoff).
Temperatura jest jednocześnie jednym z najważniejszych parametrów procesu fermentacji metanowej, stale badanym w ciągu doby. Nawet niewielkie jej wahania prowadzą do zahamowania podziału komórkowego bakterii metanowych i wzrost stężenia lotnych kwasów tłuszczowych. Prowadzi do do zakwaszenia roztworu. Przyjmuje się, że zmiana temperatury już o kilka stopni jest niebezpieczna dla procesu matanogenezy. Dopuszcza się w ciągu doby zmianę temperatury w komorach fermentacyjnych nie większą niż 2°C. Wpływ temperatury na szybkość procesu pokazuje kolejny wykres.

Rys. Ilość gazu uzyskana z kilograma s.m. osadu w komorze fermentacyjnej w zależności od temperatury procesu. (źr. Imhoff)
pH procesu
Optymalny poziom odczynu dla przemian beztlenowych mieści sie w granicach pH od 6,8-7,4, przy czym rozwój baterii metanogennych ma optimum w mniejszym oknie – przy pH od 7,0-7,2. Znaleziono co prawda bakterie metanogenne funkcjonujące przy znacznie niższych wartościach, w roztworach kwaśnych, ale wielkość produkcji biogazu była tutaj dużo mniejsza. Poniżej przedstawiam wykresy z badań prowadzonych przez Laya i wsp.
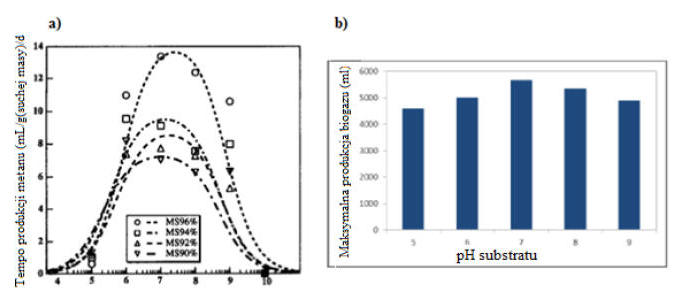
Rys. Szybkość produkcji metanu w zależności od pH i wilgotności substratu (a) [Lay i wsp., 1997]; Maksymalna produkcja biogazu w zależności od pH (b) [Jayaray i wsp., 2014]
W prawidłowo działającej komorze fermentacyjnej odczyn powinien być obojętny, do lekko zasadowego, przy jednoczesnej zwartości LKT na poziomie 100-500 g/m3. (LKT – lotne kwasy tłuszczowe). Zasadowość komory winna wynosić nie mniej niż 500 g CaCO3/m3. Odczyn pH ma duży wpływ na skład gazu pofermentacyjnego. Przy niskim pH wyraźnie rośnie stężenie dwutlenku węgla, kosztem zawartości metanu.

Rys. Wpływ odczynu osadów ściekowych na skład biogazu. (źr. Nasierowska A. Fermentacja metanowa jako sposób unieszkodliwiania osadów ściekowych)
Zawartość substancji toksycznych
W procesie fermentacji jedne substancje potrafią działać stymulująco na produkcje biogazu, inne inhibitująco. Do substancji stymulujących należą węglowodany, tłuszcze, białka, itp. Opóźniające proces fermentacji, a nawet potrafiące go zatrzymać, to: metale ciężkie, azot amonowy, węglowodory, lotne kwasy tłuszczowe (LKT). To, czy dany związek jest toksyczny, zależy w dużej mierze od formy jego występowania, stężenia, aktualnej wartości pH roztworu, itp. Substancje toksyczne mogą być doprowadzane z zewnątrz, wraz z nowym wsadem do komory, jak i powstawać w trakcie procesu fermentacji.
Przykładem związków powstających w takcie procesu metanizacji osadów, są LKT (lotne kwasy tłuszczowe), będące produktem przemiany materii. Zaliczają się do nich kwasy: masłowy, propionowy, octowy. Niewielkie ich ilości nie mają wpływu na produkcje metanu, jednak wzrost >2000 mg CH3COOH/dm3 staje się inhibitujący z powodu zbyt dużego obniżenia pH.
W przypadku azotu amonowego, niewielkie jego ilości mogą nawet działać stymulująco, podczas gdy zbyt duże mają charakter toksyczny, zwłaszcza przy podniesionym pH>7,6 (tabela 1).
Tabela 1. Działanie azotu amonowego na fermentację metanową według Benefield i Randall
| Zawartość azotu amonowego w mg N/dm3 osadu w komorze | Efekt działania na produkcję metanu |
| 50-200 | stymulująco |
| 200-1000 | bez wpływu |
| 1500-3000 | inhibicja przy pH=7,4-7,6 |
| >3000 | działanie toksyczne, zwłaszcza przy pH >7,6 |
Metale ciężkie są niebezpieczne dla procesu fermentacji metanowej jeśli występują w formie jonowej. Przy formie związanej, w postaci siarczków, fosforanów, nie stanowią zagrożenia. Pojawienie się np. w gazie pofermentacyjnym siarkowodoru świadczy o tym, że w komorze nie ma miejsca toksyczne działanie metali, bowiem obecność tego gazu ma miejsce, gdy metale zostaną związane w postaci siarczków. Inhibitujące działanie metali lekkich, jak wapń, sód, itp pojawia się dopiero przy ich dużym stężeniu. (tabela 2)
Tabela 2. Stymulujące i inhibitujące działanie metali lekkich na fermentację metanową. (źr. Poradnik eksploatatora oczyszczalni ścieków, str.320)
| Kation metalu | zawartość w osadzie w g/m3 | ||
| stymulacja | średnia inhibicja | silna inhibicja ≥ | |
| Ca | 100-200 | 2500-4500 | 8000 |
| Mg | 75-150 | 1000-1500 | 3000 |
| K | 200-400 | 2500-4000 | 12000 |
| Na | 100-200 | 3500-5500 | 8000 |
Warto zwrócić uwagę, że łączne występowanie w osadzie niektórych jonów ma działanie synergistyczne (zwiększa toksyczność), a w innym przypadku antagonistyczne (zmniejsza toksyczność danych jonów). (patrz tabela 3).
Tabela 3. Synergistyczne i antagonistyczne połączenia jonów (źr. Kugelman)
| Kation toksyczny | działanie synergistyczne | działanie antagonistyczne |
| NH4 (+) | Ca, Mg, K | Na |
| Ca (+2) | NH4 (+), Mg | K, Na |
| Mg | NH4 (+), Ca | K, Na, Ca |
| Na | NH4 (+), Ca, Mg | K |
W przypadku metali ciężkich stężenie inhibitujące pokazuje tabela 4.
Tabela 4. Zawartość metali ciężkich mająca toksyczny wpływ na metanizację osadu. (źr. Wandrasz 2006.; Landrat, 2005)
| Metal | stężenie inhibitujące |
| kadm | 150 [mmol/kg m.s.] |
| żelazo | 1710 [mmol/kg m.s.] |
| chrom +6 | 3 [mg/dm3] |
| chrom +3 | 500 [mg/dm3] |
| nikiel | 2 [mg/dm3] |
Mieszanie osadu
Mieszanie osadu zapewnia jego jednolitą strukturę w całej objętości komory oraz wyrównanie temperatury, zapewniające prawidłowy rozwój bakterii metanogennych. Jego intensywność zależy o temperatury fermentacji. Im większa tym bardziej intensywne mieszanie. W wydzielonych, zamkniętych komorach fermentacyjnych, mieszanie powinno się odbywać cały czas, przy czym wydajność urządzeń mieszających należy przyjmować:
- dla fermentacji psychrofilowej, 2-4 V (m3/d), gdzie V jest objętością komory fermentacyjnej (np. dla komory 1000m3 będzie to odpowiednio 2000-4000 m3/d)
- dla fermentacji mezofilowej, 6-10 V (m3/d)
- dla fermentacji termofilowej 10-12 V (m3/d)
Mieszanie wsadu w komorach może się odbywać w sposób mechaniczny, mieszaczami wewnętrznymi lub zewnętrznymi, bądź za pomocą sprężonego gazu.